פורמולה של אמוניה. אמוניום הידרוקסיד הוא פתרון מימי של אמוניה
אמוניה - מימן ניטריד - אחד התרכובות החשובות ביותר של חנקן ומימן. זה גז ללא צבע, אבל עם ריח חריף. ההרכב הכימי משקף את הנוסחה של אמוניה - NH3. הגדלת הלחץ או הורדת הטמפרטורההחומר מוביל להפיכתו לנוזל חסר צבע. גזים אמוניה ופתרונותיה נמצאים בשימוש נרחב בתעשייה וחקלאות. ברפואה, 10% אמוניום הידרוקסיד משמש - אמוניה.
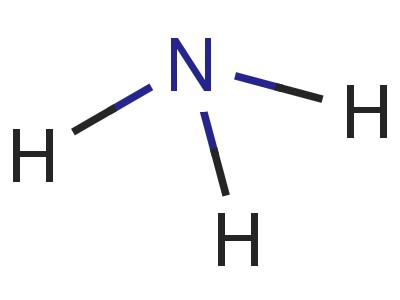
מבנה המולקולה. נוסחה אלקטרונית של אמוניה
מולקולה של ניטריד מימן בצורת דומהפירמידה, שבבסיסה יש חנקן, מחובר לשלושה אטומי מימן. אג"ח N-H הם מקוטבים מאוד. חנקן מושך את זוג האלקטרונים המחייב חזק יותר. לכן, המטען השלילי מצטבר על האטומים N, החיוב חיובי מתרכז במימן. המודל של המולקולה, הנוסחה האלקטרונית והמבנה של אמוניה, נותן מושג על תהליך זה.
מימן ניטריד מתמוסס היטב במים(700: 1 ב 20 ° C). נוכחותם של פרוטונים חופשיים כמעט מובילה להיווצרותם של מימן "גשרים" רבים המחברים את המולקולות יחד. תכונות של מבנה מליטה כימית גם להוביל העובדה כי אמוניה היא מעובה בקלות על ידי הגדלת הלחץ או על ידי הורדת הטמפרטורה (-33 ° C).

מקור השם
המונח "אמוניה" הוכנס לשימוש מדעי ב1801 על פי הצעתו של הכימאי הרוסי יה זחרוב, אבל החומר של האנושות מוכר מן העת העתיקה. גז עם ריח חריף הוא שוחרר כאשר decaying מוצרים של פעילות חיונית, תרכובות אורגניות רבות, למשל, חלבונים ו אוריאה, במהלך הפירוק של מלחי אמוניום. ההיסטוריונים של הכימיה מאמינים כי החומר נקרא על שמו של האל המצרי הקדמון עמון. בצפון אפריקה יש נווה מדבר של סיווה (עמון). מוקף במדבר לוב, יש חורבות של עיר עתיקה ומקדש, לידו יש הפקדות של אמוניום כלורי. חומר זה באירופה נקרא "מלח של עמון". יש מסורת כי תושבי נווה המדבר נווה רחרח מלח במקדש.

הכנת מיטריד מימן
פיסיקאי אנגלי וכימאי ר. בויל בניסויים שרף דשן וראה את היווצרותו של עשן לבן על מקל רטוב בחומצה הידרוכלורית והופך לתוך סילון הגז שהתקבל. בשנת 1774 כימאי בריטי אחר, ד 'פריסטלי, אמוניום מחומם כלוריד עם סיד hydrated והפריד את החומר הגזי. פריסטלי כינה את המתחם "אוויר אלקליין", כי הפתרון שלו הראה את המאפיינים של בסיס חלש. הניסוי בויל, שבו אמוניה היה הגיב עם חומצה הידרוכלורית, הוסבר. כלוריום אמוניום מוצק של צבע לבן מתרחש כאשר המולקולות של חומרים מגיבים באים במגע ישיר באוויר.

נוסחה כימית של אמוניה הוקמה בשנת1875 על ידי הצרפתי ק 'ברטול, שערך ניסוי על הפירוק של החומר לתוך רכיבים מרוכבים תחת פעולה של פריקה חשמלית. עד כה, ניסויים של פריסטלי, בויל ו Berthollet כבר לשכפל במעבדות לייצור מימן ניטריד אמוניום כלורי. השיטה התעשייתית פותחה בשנת 1901 על ידי א 'לה שאטלייה, שקיבל פטנט על שיטת הסינתזה של החומר מחנקן ומימן.

פתרון אמוניה. פורמולה ומאפיינים
תמיסה מימית של אמוניה נרשמת בדרך כלל כמו hydroxide-NH4הו. זה מציג את המאפיינים של חלש חלש:
- disociates לתוך יונים NH3 + ח2O = NH4OH = NH4+ + OH-;
- צבע את הפתרון phenolphthalein בצבע ארגמן;
- אינטראקציה עם חומצות כדי ליצור מלח ומים;
- משקעים Cu (OH)2 כחומר כחול בהיר כאשר מעורבב עם מלחי נחושת מסיסים.
שיווי משקל בתגובה של אמוניה עםהמים נעקרים לעבר חומרי הגלם. ניטריד מימן שחומם מראש שורף היטב בחמצן. חמצון של חנקן מתרחשת מולקולות דיאטומית של חומר פשוט N2. הפחתת המאפיינים של אמוניה מתבטאת גם בתגובה עם תחמוצת נחושת (II).

הערך של אמוניה ופתרונותיה
מיטריד מימן משמש בייצור של מלחיםאמוניום וחומצה חנקתית - אחד המוצרים החשובים ביותר בתעשייה הכימית. אמוניה משמשת כחומר גלם לייצור סודה (על פי שיטת החנקות). התוכן של מימן ניטריד בפתרון תעשייתי מרוכז מגיע 25%. בחקלאות, נעשה שימוש בתמיסה מימית של אמוניה. פורמולה של דשן נוזלי - NH4הו. החומר משמש ישירות כמו רוטב העליון. דרכים אחרות להעשרת הקרקע בחנקן הן השימוש במלחי אמוניום: חנקות, כלורידים, פוספטים. בתנאים תעשייתיים וחצרים חקלאיים לא מומלץ לאחסן יחד דשנים מינרליים המכילים מלחי אמוניום עם אלקליות. אם שלמות החבילה מופרת, החומרים יכולים להגיב אחד עם השני כדי ליצור אמוניה ולשחרר אותו לאוויר של המקום. התרכובת הרעילה משפיעה לרעה על מערכת הנשימה, מערכת העצבים המרכזית של האדם. תערובת של אמוניה ואוויר הוא חומר נפץ.













